Physik & Chemie des Wassers
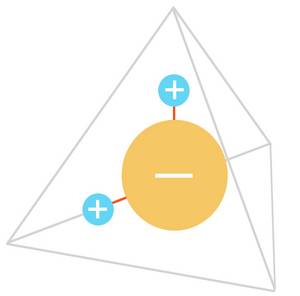
Das WASSERMOLEKÜL H2O
2 Wasserstoffatome (+)
1 Sauerstoffatom (-)
im Winkel von 104,23°
Das Wassermolekül ist ein Dipol-Molekül, was soviel bedeutet, dass an der Außenseite des Molekül-Gebildes zwei Polaritäten in Erscheinung treten. Das führt zu endlosen Andockmanövern zwischen den Molekülen, wodurch sich ganze Ketten, die so genannten Cluster bilden.
Wasser ist physikalisch gesehen in vieler Hinsicht ein Sonderling. Diese zahlreichen Besonderheiten verleihen ihm seine Schlüsselposition unter den Elementen sowie im sinfonischen Zusammenspiel innerhalb der Biologie.
AGGREGATSZUSTÄNDE, OBERFLÄCHENSPANNUNG
Wasser ist das einzige Element bzw Medium, das in fester, flüssiger und gasförmiger Form in Erscheinung tritt und diese Zustände in beliebige Richtung nahezu unbeschadet wechseln kann. Dass Wasser bei 20°C flüssig ist, erscheint bei näherer Betrachtung nicht selbstverständlich, da vergleichbare Stoffe mit derart großen Molekülen bei Raumtemperatur verdampfen.
Der Grund dafür liegt in den Wasserstoffbrücken, die auch für die enorm hohe Oberflächenspannung des Wassers sorgen, die höchste unter allen Flüssigkeiten. Dies bewirkt u.a. auch seine besondere Fähigkeit, in Kapillaren aufzusteigen.
4°C - Der ANOMALIEPUNKT
Wasser gefriert bei 0°C, und siedet & verdampft bei 100°C. Würde es sich so verhalten wie andere vergleichbare Flüssigkeiten, müsste Wasser bei -81°C seinen Siedepunkt haben. Darüber hinaus besitzt das Wasser nicht bei 0°, sondern bei +4°C seine höchste spezifische Dichte und dehnt sich aus, wenn es gefriert, etwa um 9% des Volumens. Daher ist Wasser imstande, Beton & Asphalt, ja selbst Felsen zu sprengen, wenn es zu Eis wird & wieder auftaut
LEITFÄHIGKEIT
Wasser besitzt geringe Leitfähigkeit (Elektrizität), daher ist Wasser ein guter Isolator. Der dielektrische Wert von Wasser beträgt 81 und ist damit der höchste aller chemischen Verbindungen. Der elektrische Widerstand von 1 mm3 Wasser entspricht demselben von 15 Millionen km Kupferdraht mit 1 mm Stärke.
Die Temperatur-Leitfähigkeit von Wasser, verglichen etwa mit Metallen, ist verschwindend gering: Wasser: 0,60 Kupfer: 394 Silber 429 W/(m.K)
WÄRMEKAPAZITÄT
Wasser ist jener Stoff in der Natur, der am schwersten zu erwärmen ist. Daher bildet Wasser eine hervorragende klimatische Isolierung oder Dämpfung gegen Temperaturschwankungen und Extremwerte in der Atmosphäre. Die technische Wärmekapazität von Wasser ist etwa doppelt so hoch wie die von Fichtenholz oder Eis, viermal so hoch wie die der Luft, fünfmal höher als von Beton oder Aluminium, zehnfach gegenüber Eisen und dreiunddreißig mal so hoch wie jene von Gold.
37°C - DIE SPEZIFISCHE WÄRME
Wasser besitzt eine spezifische Wärmekapazität von 4182 J/(kg.K), kann also viel thermische Energie verarbeiten, ohne sich dabei selbst stark zu erwärmen. Daher wird in umgekehrter Richtung durch die Kühlung von Wasser viel gespeicherte Energie freigesetzt - siehe Gewitter.
Unsere 37°C Körpertemperatur - der spezifische Energienullpunkt des Wassers: Um dieses Niveau aufrecht zu halten, ist im Wasser die spezifisch geringste Energiemenge nötig. Abwärts sowie aufwärts von 37°C steigt der erforderliche Energiebedarf, um die Temperatur im Wasser konstant zu halten.
WASSERPHYSIK / Uni Bayreuth, Matthias Bauer